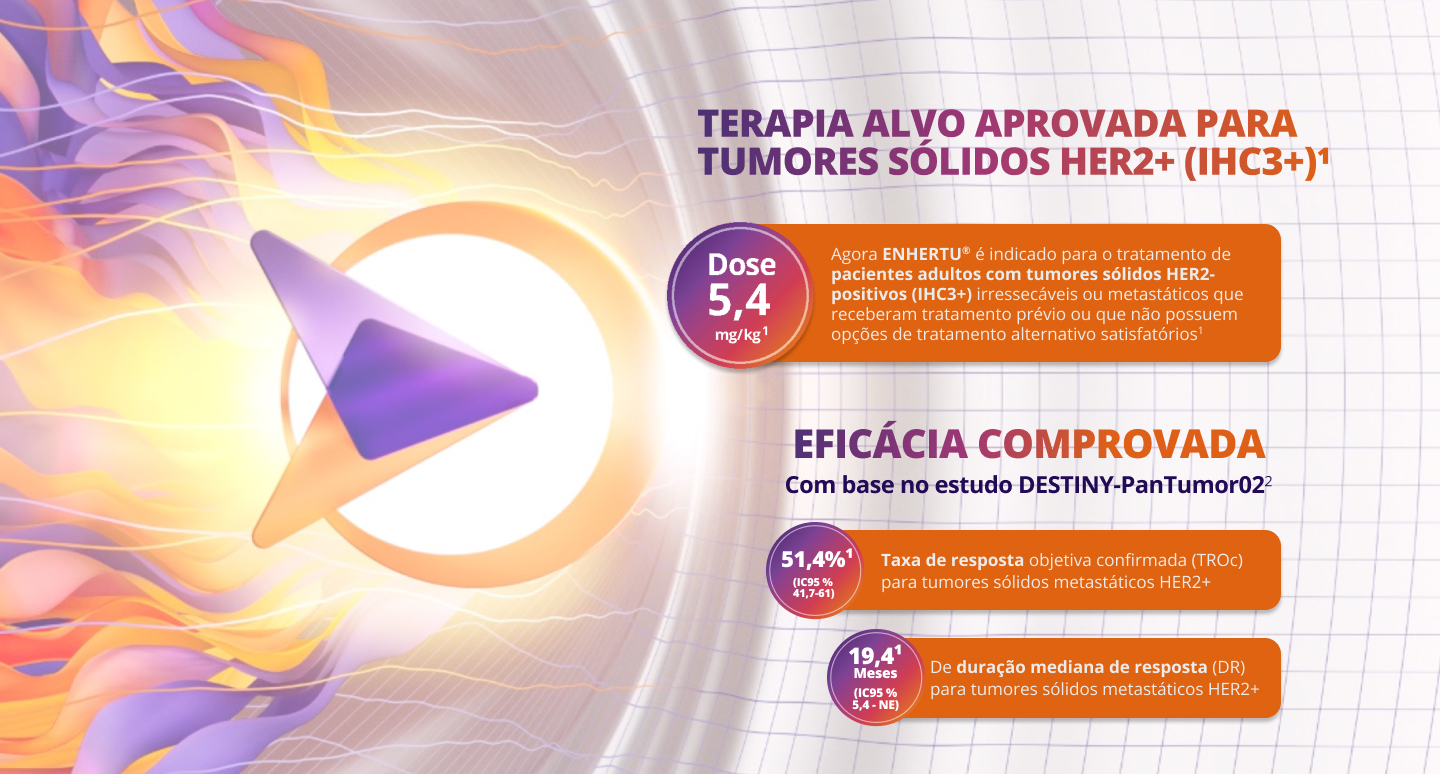

ENHERTU® estabelece um novo padrão em tratamentos.1
DESTINY-PanTumor02 é um estudo fase 2, multicêntrico, não-randomizado, aberto para avaliar a eficácia e segurança de T-DXd para o tratamento de tumores sólidos HER2+ (IHC3+) previamente tratados ou sem alternativa de tratamento.2
DESTINY-Lung01 incluiu pacientes com câncer de pulmão de não pequenas células (CPNPC) HER2-positivo (IHC 3+) irressecável ou metastático, previamente tratado. Os pacientes deveriam apresentar recidiva ou serem refratários ao tratamento padrão ou não ter tratamento padrão disponível.1
DESTINY-CRC02 incluiu pacientes com câncer colorretal (CRC) HER2-positivo (IHC 3+) previamente tratado, irressecável ou metastático. A menos que contraindicado, os pacientes deveriam ter recebido fluoropirimidina, oxaliplatina e irinotecano. Se clinicamente indicado, os pacientes deveriam ter recebido tratamento anti-EGFR, tratamento anti-VEGF e terapia anti-PDL1.1
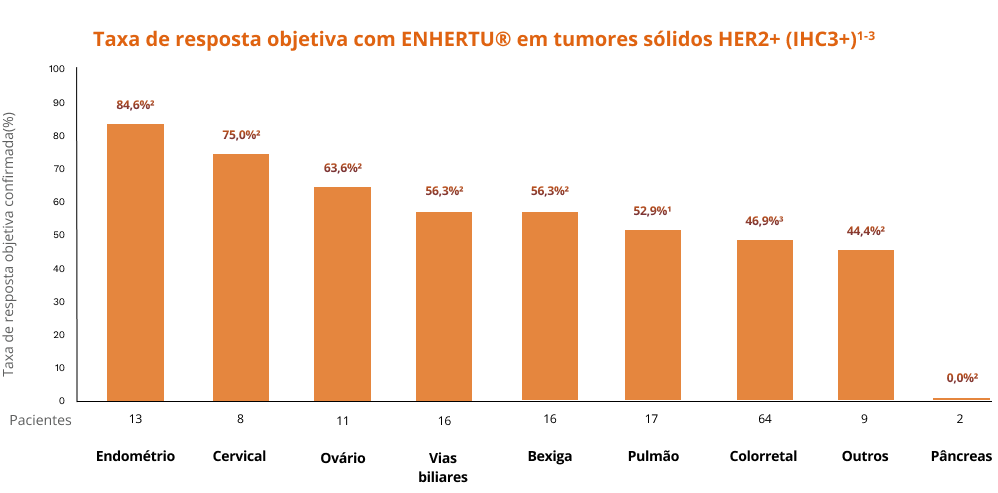
Gráfico adaptado de: Meric-Bernstam F. et al. J Clin Oncol. 2024;42(1):47-58; Bula de Enhertu®; Raghav K, et al. The Lancet Oncology, 2024;25(9):1147- 62.
ENHERTU® apresentou taxas de resposta clinicamente significativas em cânceres de pulmão, gastrointestinais, geniturinários, ginecológicos e outros cânceres raros.2
Respostas com ENHERTU® em diferentes tipos de tumores1
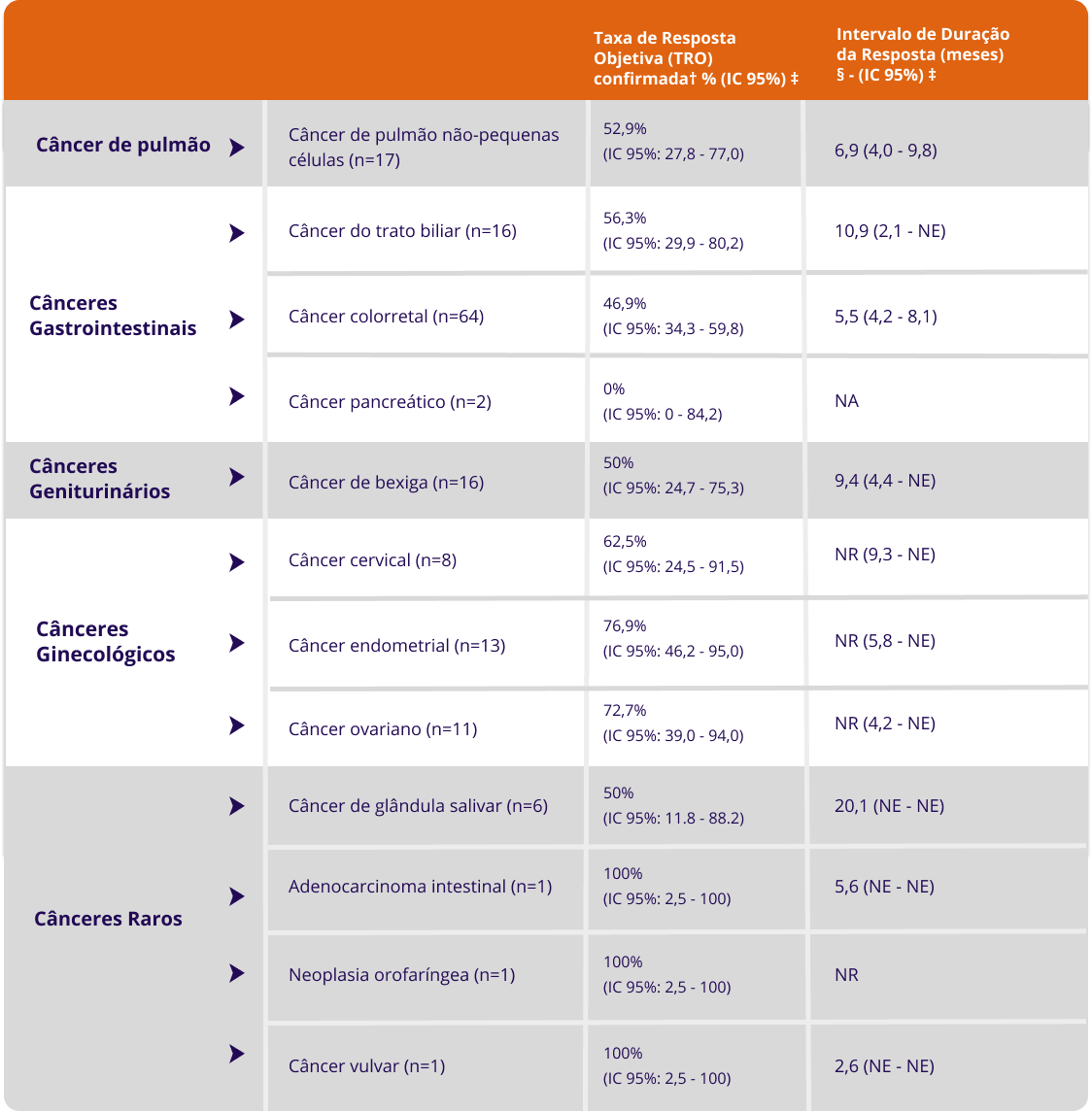
Adaptado de: Bula de Enhertu®.
IC = Intervalo de confiança, N = Pacientes, NE = Não estimável, NR = Não alcançado, NA = não aplicável
† = Avaliado por revisão central independente
‡IC = é derivado com base no método Clopper-Pearson
§ = Calculado pela técnica de Kaplan-Meier
ENHERTU® possui perfil de segurança demonstrado em 1901 pacientes de estudos agrupados1
Doença pulmonar intersticial1-4
- DIP ocorreu em 12% dos pacientes (n=18/1901); desfechos fatais devido à DIP e/ou pneumonite ocorreram em 1% dos pacientes (n=18/1901).
- A maioria dos casos de DIP foram Grau 1 ou 2.
- Tempo mediano para o primeiro surgimento foi de 5,5 meses (intervalo: 0,9-31,5).
Neutropenia1
- A diminuição na contagem de neutrófilos foi relatada em 63% para (n=1901) dos pacientes; 17% apresentaram. diminuição de neutrófilos de Grau 3 ou 4.
- O tempo mediano para o primeiro evento foi de 22 dias (intervalo de 2-939 dias).
- Neutropenia febril foi relatada em 1% dos pacientes.
Disfunção ventricular esquerda1
- A diminuição da FEVE foi relatada em 3,8% dos pacientes, dos quais 0,66% eram de Grau 3.
Reações adversas mais comuns (≥20%), incluindo anormalidades laboratoriais1
- Nos estudos agrupados, as reações adversas mais comuns (≥20%) (incluindo anomalias laboratoriais) foram náuseas (73%), diminuição da contagem de glóbulos brancos (70%), diminuição da hemoglobina (66%), diminuição da contagem de neutrófilos (63 %), diminuição da contagem de linfócitos (58%), fadiga (56%), diminuição da contagem de plaquetas (48%), aumento da aspartato aminotransferase (47%), aumento da alanina aminotransferase (43%), vômitos (40%), aumento da alcalinidade do sangue fosfatase (38%), alopecia (34%), prisão de ventre (33%), diminuição do apetite (32%), diminuição do potássio no sangue (31%), diarreia (29%), dor musculoesquelética (24%) e dor abdominal (20%).
AMPLIANDO AS ALTERNATIVAS NO TRATAMENTO DE
TUMORES HER2+ (IHC3+)1
No ano de 2024, ENHERTU® foi também aprovado para tumores sólidos HER2+ (IHC3+), ampliando significativamente o escopo de aplicação1
A inclusão de ENHERTU® como tratamento para uma variedade de tumores sólidos HER2+ (IHC3+) solidifica seu papel como uma solução na luta contra o câncer.1
Considerações para HER2+ (IHC3+) irressecáveis
ou tumores sólidos metastáticos1
- Selecione para tratamento com Enhertu® pacientes com tumores sólidos irresecáveis ou metastáticos HER2+ (IHC3+) confirmados.
ENHERTU® é administrado por infusão IV

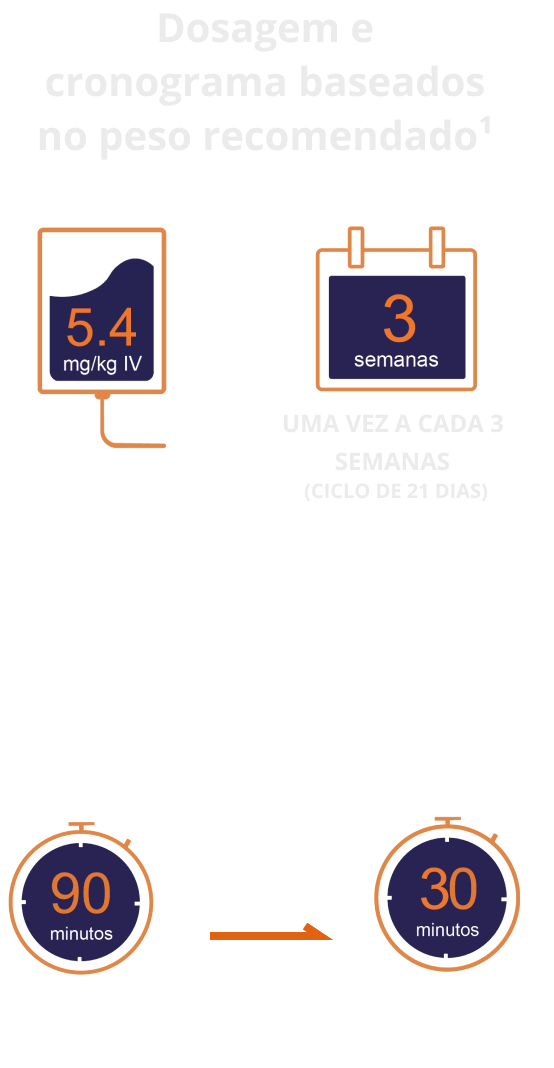
Administre ENHERTU® até progressão da doença ou toxicidade inaceitável¹
Pré-medicação1
- ENHERTU® é altamente emetogênico, o que inclui náuseas e/ou vômitos tardios. Administre medicamentos antieméticos profiláticos conforme as diretrizes institucionais5 para prevenção de náusea e vômito induzidos por quimioterapia
Apresentação1
- Solução injetável: 100 mg de ENHERTU® como pó liofilizado branco a levemente amarelado em um frasco de dose única para reconstituição e diluição subsequente
Não substitua ENHERTU® por ou com trastuzumabe ou ado-trastuzumab emtansine1
Diminua ou interrompa a taxa de infusão se o paciente desenvolver sintomas relacionados à infusão1
Interrompa permanentemente ENHERTU® em casos de reações severas à infusão1
Materiais de apoio
Confira os materiais para consulta sobre o manejo adequado de pacientes em tratamento com ENHERTU®.

Fale conosco para saber mais sobre ENHERTU®
Nosso time está pronto para te auxiliar no que precisar.
Entre em contatoReferências: 1. Bula do produto. 2. Meric-Bernstam F, Makker V, Oaknin A, et al. Efficacy and safety of trastuzumab deruxtecan in patients with HER2-expressing solid tumors: primary results from the DESTINY-PanTumor02 phase II trial. J ClinOncol. 2024;42(1):47-58. doi:10.1200/JCO.23.02005. 3. Raghav KPS, et al. Trastuzumab deruxtecan (T-DXd) in patients (pts) with HER2-overexpressing/amplified (HER2+) metastatic colorectal cancer (mCRC): primary results from the multicenter, randomized, phase 2 DESTINY-CRC02 study. J Clin Oncol. 2023;41(suppl 16):3501. doi:10.1200/JCO.2023.41.16_suppl.3501 4. Li BT, Smit EF, Goto Y, et al. Trastuzumab deruxtecan in HER2-mutant non-small-cell lung cancer. N Engl J Med. 2022;386(3):241-251. 5. NCCN - Antiemesis. version 1.2024 - December 13,2023. Disponível em: https://www.nccn.org/guidelines/guidelines-detail?category=1&id=1415
ENHERTU® (trastuzumabe deruxtecana). INDICAÇÕES: Câncer de mama: tratamento de pacientes adultos com câncer de mama HER2-positivo metastático ou não ressecável, que tenham recebido um regime de tratamento baseado em anti-HER2 no cenário metastático, ou no cenário neoadjuvante ou adjuvante, e que desenvolveram recorrência da doença durante ou dentro de 6 meses após a conclusão do tratamento. Tratamento de pacientes adultos com câncer de mama HER2 de baixa expressão (IHC 1+ ou IHC 2+/ISH-) metastático ou não ressecável que tenham recebido uma terapia sistêmica prévia no cenário metastático, ou que desenvolveram recorrência da doença durante ou dentro de 6 meses após a conclusão de quimioterapia adjuvante. Pacientes com câncer de mama HER2 de baixa expressão com receptor hormonal positivo (RH+) devem também ter recebido ou ser inelegíveis a terapia endócrina. Câncer de pulmão: tratamento de pacientes adultos com câncer de pulmão de não pequenas células (CPNPC) não ressecável ou metastático cujos tumores tenham mutações HER2 (ERBB2) ativadoras e que tenham recebido uma terapia sistêmica prévia. Câncer gástrico: tratamento de pacientes adultos com adenocarcinoma gástrico ou da junção gastroesofágica (JGE) localmente avançado ou metastático HER2-positivo que receberam regime anterior à base de trastuzumabe. Outros tumores sólidos: tratamento de pacientes adultos com tumores sólidos HER2-positivos (IHC3+) irressecáveis ou metastáticos que receberam tratamento prévio ou que não possuem opções de tratamento alternativas satisfatórias. CONTRAINDICAÇÕES: hipersensibilidade ao trastuzumabe deruxtecana ou a qualquer dos componentes da formulação. CUIDADOS E ADVERTÊNCIAS: casos de doença pulmonar intersticial (DPI) e/ou pneumonite foram relatados com ENHERTU®. Os pacientes devem ser orientados a relatar imediatamente no caso de tosse, dispneia, febre e/ou qualquer novo sintoma ou piora de sintomas respiratórios, e devem ser monitorados para sinais ou sintomas de DPI / pneumonite. Casos de neutropenia, incluindo neutropenia febril foram relatados nos estudos clínicos de ENHERTU®. O hemograma completo deve ser monitorado antes do início do tratamento com ENHERTU® e antes de cada dose, conforme clinicamente indicado. Redução da fração de ejeção de ventrículo esquerdo (FEVE) é observada com terapias anti-HER2. A FEVE deve ser avaliada antes do início do tratamento com ENHERTU® e em intervalos regulares durante o tratamento, conforme clinicamente indicado. Categoria de risco na gravidez: D. A administração de ENHERTU® a gestantes não é recomendada e as pacientes devem ser informadas dos potenciais riscos ao feto antes de engravidarem. Mulheres que engravidarem devem imediatamente contatar seu médico. Caso uma mulher engravide durante o tratamento com ENHERTU®, ou em até sete meses após a última dose do tratamento, é recomendado monitoramento próximo. Lactação: não se sabe se ENHERTU® é excretado no leite materno humano. Como muitos fármacos são excretados no leite humano, e devido ao potencial de reações adversas graves em lactentes em aleitamento materno, as mulheres devem descontinuar a amamentação antes do início do tratamento com ENHERTU®. As mulheres podem iniciar o aleitamento sete meses após a última dose do tratamento. INTERAÇÕES MEDICAMENTOSAS: a coadministração com ritonavir aumentou a exposição do trastuzumabe deruxtecana em 19% e do inibidor da topoisomerase I livre em 22%. Não é necessário ajuste de dose durante a administração concomitante de ENHERTU® com medicamentos inibidores da OATP1B ou CYP3A. Não é esperada interação clinicamente significativa com medicamentos inibidores da P-gp, MATE2-K. MRP1 ou transportadores BCRP. REAÇÕES ADVERSAS: náusea, fadiga, vômito, alopecia, constipação, redução do apetite, anemia, neutropenia, diarreia, dor abdominal, estomatite, dispepsia, trombocitopenia, tosse, leucopenia, neutropenia, linfopenia, pirexia, transaminase aumentadas, fosfatase alcalina aumentada, infecção do trato respiratório superior, hipocalemia, dor muscoloesquelética, dor de cabeça, doença pulmonar intersticial, dispneia, epistaxe, erupção cutânea, redução de peso, tontura, edema periférico, pneumonia, diminuição de sódio. POSOLOGIA: ENHERTU® deve ser administrado em infusão intravenosa a cada 3 semanas (ciclo de 21 dias), até progressão da doença ou toxicidade não manejável. Câncer de mama, câncer de pulmão, outros tumores sólidos: a dose recomendada é 5,4 mg/kg. Câncer gástrico: a dose recomendada é 6,4 mg/kg. Pode ser necessária a interrupção temporária, redução de dose ou descontinuação do tratamento com ENHERTU® em decorrência de reações adversas. USO RESTRITO A ESTABELECIMENTOS DE SAÚDE. VENDA SOB PRESCRIÇÃO MÉDICA. Registro: 1.0454.0191. Registrado por: Daiichi Sankyo Brasil Farmacêutica Ltda. Serviço de Atendimento ao Consumidor: 0800-055-6596. Informações adicionais à disposição da classe médica. SE PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO. MB_07
