DESTINY-Breast06
Nova indicação
O estudo clínico DESTINY-Breast06 marca um novo capítulo na história de ENHERTU® (trastuzumabe deruxtecana), estabelecendo sua eficácia em uma população mais ampla de pacientes com câncer de mama metastático HR+, incluindo aquelas com níveis muito baixos de expressão de HER2 (IHC 0 com coloração de membrana), anteriormente classificadas como HER2-negativas.1-4, 9
Com base nos resultados do estudo, ENHERTU® passou a ser indicado como monoterapia para pacientes com CMM:1-4, 9

HER2-low (IHC 1+ ou IHC 2+/ISH−) e HER2-ultralow (IHC 0 com coloração de membrana) que tenham recebido pelo menos uma linha de terapia endócrina no cenário metastático.

Além disso, também está aprovado para pacientes com câncer de mama HER2-low que tenham recebido uma terapia sistêmica prévia no cenário metastático ou desenvolvido recorrência da doença durante ou em até 6 meses após o término da quimioterapia adjuvante.
CMM = câncer de mama metastático | IHC = imunohistoquímica | ISH = hibridização in situ | HR+ = receptor hormonal positivo
HER2-low e HER2-ultralow: como diferenciar e por que importa5
A categoria IHC 0 não indica ausência absoluta de expressão da proteína HER2. Na prática, pode haver coloração tênue e incompleta em ≤10% das células tumorais – e essa sutil expressão já é suficiente para caracterizar um perfil HER2-ultralow.5, 8
Segundo o protocolo do DESTINY-Breast06, esse grau mínimo de coloração já pode identificar uma paciente elegível para ENHERTU®.
IHC 0 nem sempre indica ausência de expressão da proteína HER25
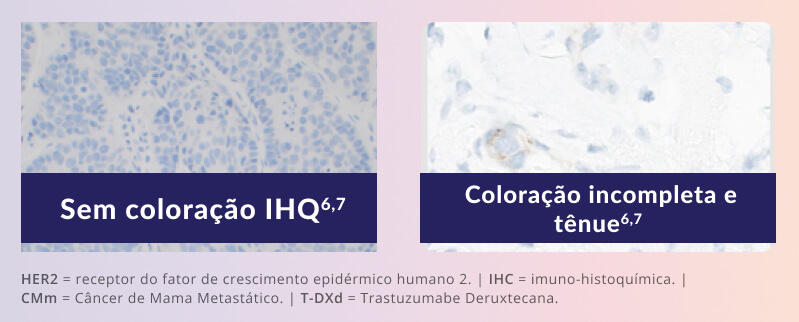
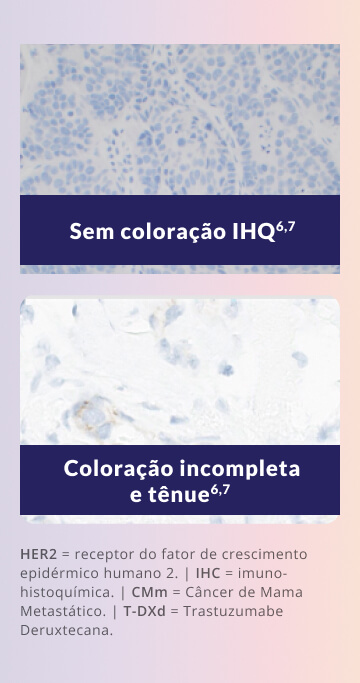
A categoria IHC 0 abrange um espectro de intensidades de coloração, uma vez incluir expressões tanto de HER2-nulo quanto de HER2-ultralow8
Pelo protocolo do DESTINY-Breast06, coloração das membranas tênue ou quase imperceptível e incompleta em <10% das células tumorais foi suficiente para ser considerado HER2-ultralow.5
O DESTINY-Breast06 continua a explorar além do DESTINY-Breast041, 9-12
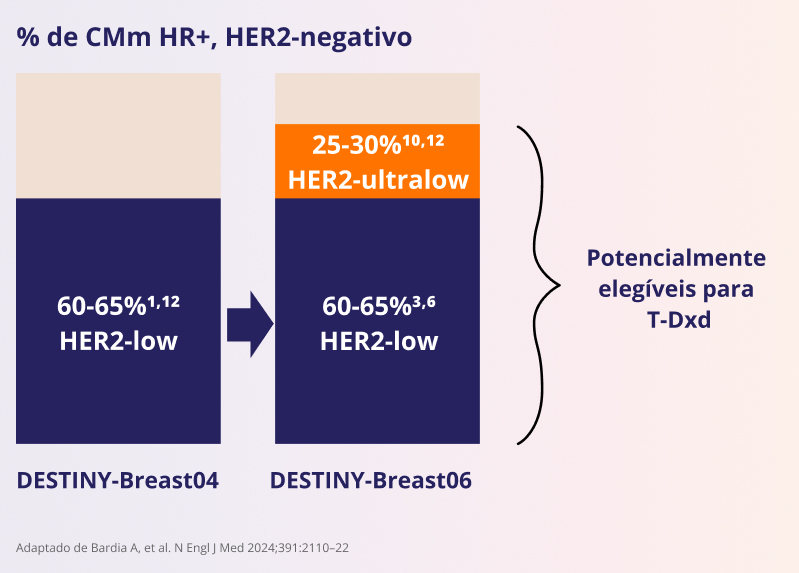
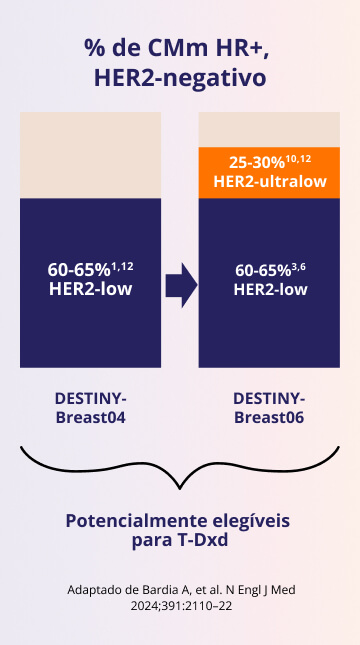
Expande a proporção de pacientes que podem se beneficiar de T-DXd para ~85% de CMm . RH+, HER21
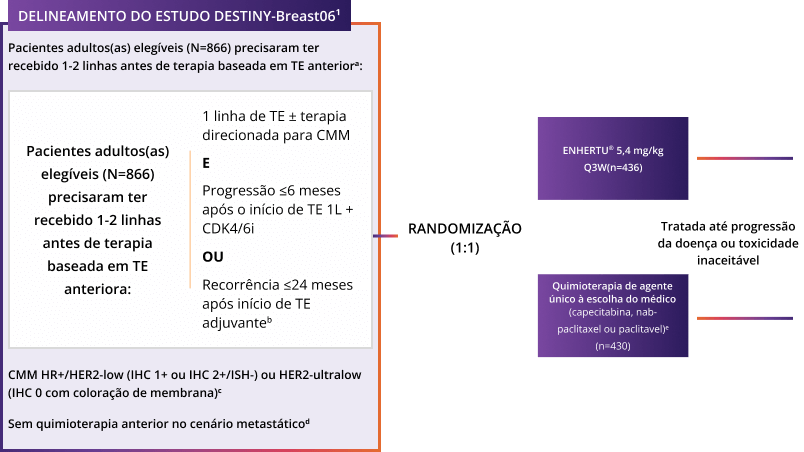
Desenho do Estudo1-4
Estudo aberto, randomizado, multicêntrico. População ITT: 866 pacientes.
- Tratamento experimental: ENHERTU® 5,4 mg/kg Q3W (n=436)
- Tratamento controle: Quimioterapia à escolha do médico (capecitabina, nab-paclitaxel ou paclitaxel) (n=430)
- Tratamento até progressão da doença ou toxicidade inaceitável
Critérios de inclusão
ENHERTU® foi avaliado em um estudo de superioridade Fase 3 em pacientes com CMM HR + após 1-2 linhas de TE1, 2
Um estudo aberto, randomizado, multicêntrico1



Adaptado de: Bardia A et al. N Engl J Med. 2024 Dec 5;391(22):2110-2122.
BICR = Blinded Independent Central | CMm = Câncer de Mama Metastático. | HR = Hazard Ratio = Razão de Risco. | ITT = Intenção de tratar. | IHC = Imunohistoquímica. | SLPm = Sobrevida Livre de Progressão mediana. | TRO = Taxa de resposta objetiva | DR = Duração de resposta.
a. Critérios de exclusão incluíram um histórico de DPI/pneumonite exigindo tratamento com esteroides ou DPI/pneumonite na triagem, doença cardiovascular não controlada ou significativa, metástases cerebrais não tratadas e sintomáticas ou status de desempenho ECOG. b. Apenas 1 linha de TE no cenário metastático exigida. c. Conforme determinado pelo PATHWAY/VENTANA anti-HER2/neu (4B5) avaliado em um laboratório central. HER2-ultralow foi definido como coloração fraca e parcial da membrana em ≤10% das células cancerosas (também conhecido como IHC >0<1+). d. Os(As) pacientes poderiam ter recebido quimioterapia no cenário neoadjuvante ou adjuvante desde que tivessem um intervalo livre de doença de >12 meses. e. No braço de controle, 60% dos(as) pacientes receberam capecitabina, 24% nab-paclitaxel e 16% paclitaxel. f. SLP baseada em RECIST v1.1.1
Eficácia e Segurança
Desfecho primário
ENHERTU® tem eficácia superior com 13,2 meses de sobrevida livre de progressão mediana (SLPm).¹
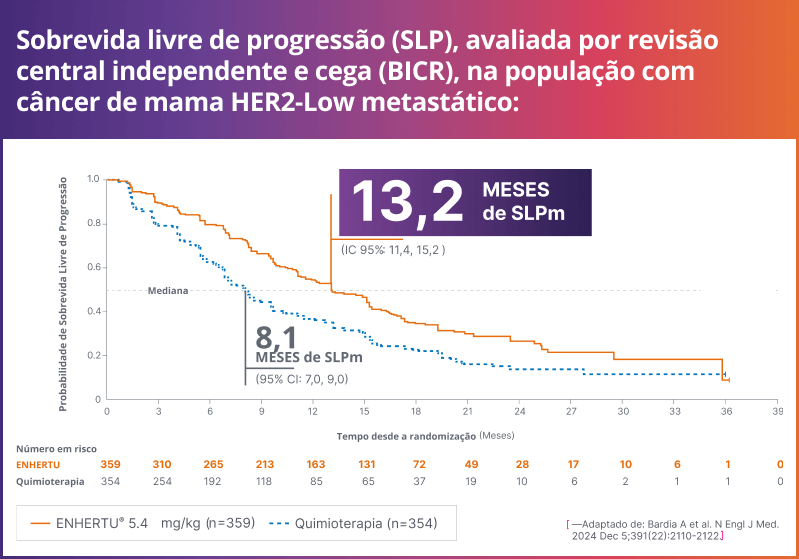
Seguimento mediano: 18,2 meses (HER2-low + HER2-ultralow)1
Os dados de sobrevida global estavam imaturos no momento da análise1


Taxa de resposta
A maioria dos pacientes alcançou uma resposta objetiva confirmada1
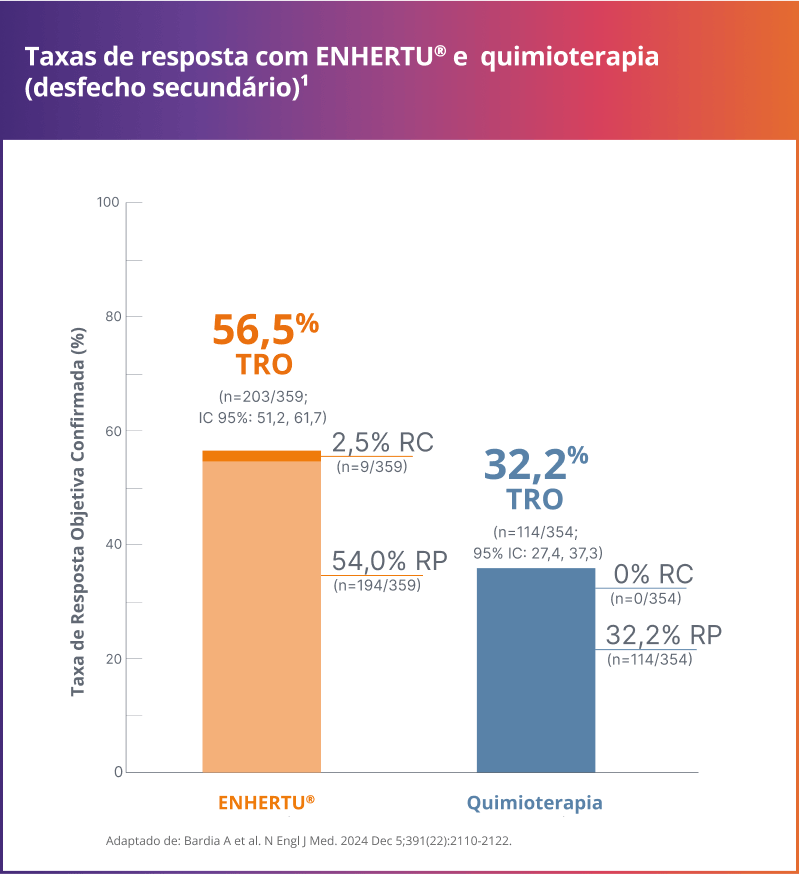
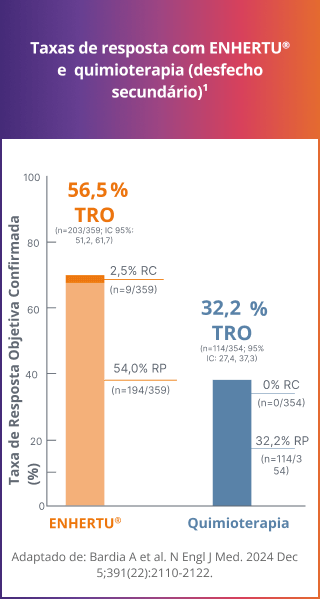
Resultados consistentes foram observados na população ITT, que incluiu pacientes com câncer de mama metastático RH+/HER2-ultralow.1


SLPm (HER2-low): 13,2 meses (IC 95%: 11,4-15,2) com ENHERTU® vs. 8,1 meses (IC 95%: 7,0-9,0) com quimioterapia (HR: 0,62; P<0,0001)1, 3
População ITT: 13,2 meses vs. 8,1 meses (HR: 0,64; P<0,0001)1, 3
TRO (HER2-low): 56,5% com ENHERTU® vs. 32,2% com quimioterapia1, 3
DRm: 14,1 meses com ENHERTU® (IC de 95%: 11,8, 15,9) vs. 8,6 meses sem quimioterapia (IC de 95%: 6,7, 11,3)1, 3
SLPm: Sobrevida livre de progressão mediana. | ITT: Intenção de tratar | TRO: Taxa de resposta objetiva | DRm: Duração de resposta mediana.
Os desfechos de eficácia foram consistentes nas populações HER2-low, ITT e HER2-ultralow1
Resumo dos resultados de eficácia do DESTINY-Breast06 por população de pacientes
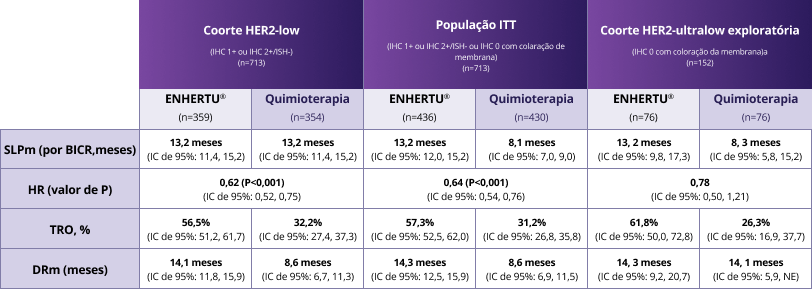
Adaptado de Bardia A, et al. N Engl J Med 2024;391:2110–22
No momento da análise, os dados de sobrevida global ainda não estavam maduros; houve uma tendência positiva favorecendo ENHERTU® na coorte HER2-low (HR: 0,83; IC de 95%: 0,66 1,05) e população ITT (HR: 0,81; IC de 95%: 0,66 1,01)3
A melhora na SLP com ENHERTU® versus quimioterapia foi consistente entre populações de pacientes1, 2
ITT: Intenção de tratar. | SLPm: Sobrevida livre de progressão mediana | HR: Hazard ratio | TRO: Taxa de resposta objetiva | DRm: Duração da resposta mediana | SLP: Sobrevida livre de progressão
Segurança
O perfil de segurança de ENHERTU® em CMM HR+/HER2-low foi estabelecido também no DESTINY-Breast062
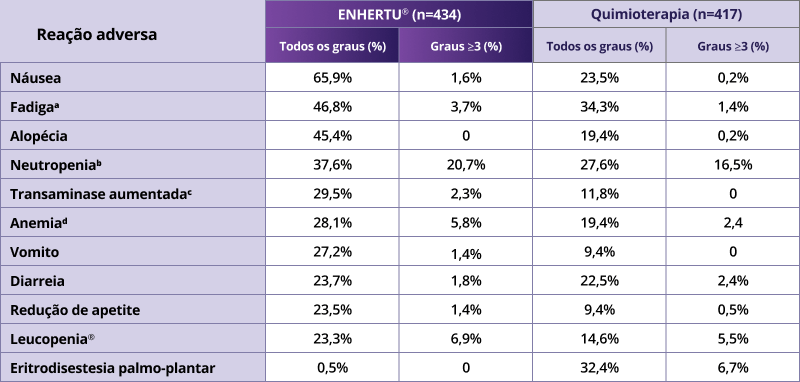
Adaptado de Bardia A, et al. N Engl J Med 2024;391:2110–22

A maioria das reações adversas foi de Grau 1 ou 2.1

Os três eventos adversos mais comuns de Grau 3 ou superior que ocorreram em ambos os grupos de tratamento foram neutropenia, leucopenia e anemia.1

A taxa de descontinuação devido a eventos adversos foi de 14,3% com ENHERTU® versus 9,4% com quimioterapia. E de redução de dose foi 24,7% dos pacientes no grupo com ENHERTU® e 38,6% daqueles no grupo com quimioterapia.1

ILD/pneumonite relacionada ao medicamento ocorreu em 11,3% (n=49) dos pacientes que
receberam ENHERTU®.1
Pneumonite grau 3 ou superior ocorreu em 1,14% (n=6) dos pacientes tratados com
ENHERTU®.1
Adaptado de Bardia A, et al. N Engl J Med. 2024;391(22):2110-2122 - supplement
QUALIDADE DE VIDA REPORTADA PELOS PACIENTES
Desfechos de qualidade de vida (QLQ-C30) de ENHERTU® vs TEM no CMm HER2-Low:22

Adaptado de: Hu X, et al. ESMO Open. 2025 May;10(5):105082. doi: 10.1016/j.esmoop.2025.105082
ITT = Intenção de tratar. | T-DXd = Trastuzumabe deruxtecana. | TEM = Terapia de Escolha do Médico | GHS/QOL = Saúde Global/Qualidade de Vida. | IC = intervalo de confiança. | HR = Razão de risco. | NR = não se alcançou. | TTD = Tempo para deteorização definitiva | CMM = câncer de mama metastático.
Selecione a Indicação de Enhertu®
Referências
1. Bardia A, Hu X, Dent R, et al; DESTINY-Breast06 Trial Investigators. Trastuzumab deruxtecan after endocrine therapy in metastatic breast cancer. N Engl J Med 2024;391:2110–22. 2. ClinicalTrials.gov. NCT04494425. https:// www.clinicaltrials.gov/study/NCT04494425. Acesso em: 19/05/2025. 3. Curigliano G et al. J Clin Oncol 42, 2024 (suppl 17; abstr LBA1000). 4. Bardia A, et al. Highlights in Metastatic Breast Cancer From the 2024 San Antonio Breast Cancer Symposium. Clinical Advances in Hematology & Oncology. 2025;23(1,supl2):6-9 5. Wolff AC, et al. Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer. Arch Pathol Lab Med. 2023 Sep 1;147(9):993-1000. 6. HER2 Know. ICH Staining Atlas. Disponível em: https://www.her2know.com/home/ihcatlas. html#tabs-803c56b4e2-item-469437a111-tab Acessado em Agosto/2024 7. Allison K, Krishnamurti U, et al. College of American Pathologists. 2025. Disponível em: https://documents.cap.org/documents/New-Cancer-Protocols-March2025/Breast.Bmk_1.6.0.0.REL.CAPCP.pdf. Acessado em 03/04/2025 8. Nicolò E, Boscolo Bielo L, Curigliano G, Tarantino P. The HER2-low revolution in breast oncology: steps forward and emerging challenges. Ther Adv Med Oncol. 2023 Feb 9;15:17588359231152842. 9. Bula de ENHERTU® 10. Chen Z, et al. Is HER2 ultra-low breast cancer different from HER2 null or HER2 low breast cancer? A study of 1363 patients. Breast Cancer Res Treat. 2023 Nov;202(2):313-323. 11. Mehta S, et al. J Clin Oncol. 2024;42(Suppl. 16):Abstract e13156. 12. Denkert C, et al. Lancet Oncol. 2021;22:1151–1161 13. Finn RS, et al. N Engl J Med. 2016;375:1925–1936. 14. Hortobagyi GN,et al. Updated results from MONALEESA-2, a phase III trial of first-line ribociclib plus letrozole versus placebo plus letrozole in hormone receptor-positive, HER2-negative advanced breast cancer. Ann Oncol. 2018 Jul 1;29(7):1541-1547. Erratum in: Ann Oncol. 2019 Nov 1;30(11):1842. 15. Johnston S, et al. MONARCH 3 final PFS: a randomized study of abemaciclib as initial therapy for advanced breast cancer. NPJ Breast Cancer. 2019 Jan 17;5:5. doi: 10.1038/s41523-018-0097-z. 16. Turner NC, et al. Capivasertib in Hormone Receptor-Positive Advanced Breast Cancer. N Engl J Med. 2023 Jun 1;388(22):2058-2070- Supplementary. 17. Nicholas C. et al. Capivasertib in Hormone Receptor–Positive Advanced Breast Cancer. N Engl J Med 2023;388:2058–2070 DOI: 10.1056/NEJMoa2214131. 18. Bidard FC, Ket al. Elacestrant (oral selective estrogen receptor degrader) Versus Standard Endocrine Therapy for Estrogen Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative Advanced Breast Cancer: Results From the Randomized Phase III EMERALD Trial. J Clin Oncol. 2022 Oct 1;40(28):3246-3256. 19. O’ S haughnessy J, et al. Abstract GS4-01: Results from CONTESSA: A phase 3 study of tesetaxel plus a reduced dose of capecitabine versus capecitabine alone in patients with HER2-, hormone receptor + (HR+) metastatic breast cancer (MBC) who have previously received a taxane. Cancer Res. 2021;81(Suppl. 4):Abstract GS4-01. 20. Robert NJ, et al.. RIBBON-1: randomized, double-blind, placebo-controlled, phase III trial of chemotherapy with or without bevacizumab for first-line treatment of human epidermal growth factor receptor 2-negative, locally recurrent or metastatic breast cancer. J Clin Oncol. 2011 Apr 1;29(10):1252-60. 21. Modi S, et al DESTINY-Breast04 Trial Investigators. Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. N Engl J Med. 2022 Jul 7;387(1):9-20. 22. Hu X, et al. Patient-reported outcomes with trastuzumab deruxtecan in hormone receptor-positive, HER2-low or HER2-ultralow metastatic breast cancer: results from the randomized DESTINY-Breast06 trial. ESMO Open. 2025 May;10(5):105082.
ENHERTU® (trastuzumabe deruxtecana). INDICAÇÕES: Câncer de mama: tratamento de pacientes adultos com câncer de mama HER2-positivo metastático ou não ressecável, que tenham recebido um regime de tratamento baseado em anti-HER2 no cenário metastático, ou no cenário neoadjuvante ou adjuvante, e que desenvolveram recorrência da doença durante ou dentro de 6 meses após a conclusão do tratamento. Tratamento de pacientes adultos com câncer de mama HER2 de baixa expressão (IHC 1+ ou IHC 2+/ISH-) metastático ou não ressecável que tenham recebido uma terapia sistêmica prévia no cenário metastático, ou que desenvolveram recorrência da doença durante ou dentro de 6 meses após a conclusão de quimioterapia adjuvante. Pacientes com câncer de mama HER2 de baixa expressão com receptor hormonal positivo (RH+) devem também ter recebido ou ser inelegíveis a terapia endócrina. Câncer de pulmão: tratamento de pacientes adultos com câncer de pulmão de não pequenas células (CPNPC) não ressecável ou metastático cujos tumores tenham mutações HER2 (ERBB2) ativadoras e que tenham recebido uma terapia sistêmica prévia. Câncer gástrico: tratamento de pacientes adultos com adenocarcinoma gástrico ou da junção gastroesofágica (JGE) localmente avançado ou metastático HER2-positivo que receberam regime anterior à base de trastuzumabe. Outros tumores sólidos: tratamento de pacientes adultos com tumores sólidos HER2-positivos (IHC3+) irressecáveis ou metastáticos que receberam tratamento prévio ou que não possuem opções de tratamento alternativas satisfatórias. CONTRAINDICAÇÕES: hipersensibilidade ao trastuzumabe deruxtecana ou a qualquer dos componentes da formulação. CUIDADOS E ADVERTÊNCIAS: casos de doença pulmonar intersticial (DPI) e/ou pneumonite foram relatados com ENHERTU®. Os pacientes devem ser orientados a relatar imediatamente no caso de tosse, dispneia, febre e/ou qualquer novo sintoma ou piora de sintomas respiratórios, e devem ser monitorados para sinais ou sintomas de DPI / pneumonite. Casos de neutropenia, incluindo neutropenia febril foram relatados nos estudos clínicos de ENHERTU®. O hemograma completo deve ser monitorado antes do início do tratamento com ENHERTU® e antes de cada dose, conforme clinicamente indicado. Redução da fração de ejeção de ventrículo esquerdo (FEVE) é observada com terapias anti-HER2. A FEVE deve ser avaliada antes do início do tratamento com ENHERTU® e em intervalos regulares durante o tratamento, conforme clinicamente indicado. Categoria de risco na gravidez: D. A administração de ENHERTU® a gestantes não é recomendada e as pacientes devem ser informadas dos potenciais riscos ao feto antes de engravidarem. Mulheres que engravidarem devem imediatamente contatar seu médico. Caso uma mulher engravide durante o tratamento com ENHERTU®, ou em até sete meses após a última dose do tratamento, é recomendado monitoramento próximo. Lactação: não se sabe se ENHERTU® é excretado no leite materno humano. Como muitos fármacos são excretados no leite humano, e devido ao potencial de reações adversas graves em lactentes em aleitamento materno, as mulheres devem descontinuar a amamentação antes do início do tratamento com ENHERTU®. As mulheres podem iniciar o aleitamento sete meses após a última dose do tratamento. INTERAÇÕES MEDICAMENTOSAS: a coadministração com ritonavir aumentou a exposição do trastuzumabe deruxtecana em 19% e do inibidor da topoisomerase I livre em 22%. Não é necessário ajuste de dose durante a administração concomitante de ENHERTU® com medicamentos inibidores da OATP1B ou CYP3A. Não é esperada interação clinicamente significativa com medicamentos inibidores da P-gp, MATE2-K. MRP1 ou transportadores BCRP. REAÇÕES ADVERSAS: náusea, fadiga, vômito, alopecia, constipação, redução do apetite, anemia, neutropenia, diarreia, dor abdominal, estomatite, dispepsia, trombocitopenia, tosse, leucopenia, neutropenia, linfopenia, pirexia, transaminase aumentadas, fosfatase alcalina aumentada, infecção do trato respiratório superior, hipocalemia, dor muscoloesquelética, dor de cabeça, doença pulmonar intersticial, dispneia, epistaxe, erupção cutânea, redução de peso, tontura, edema periférico, pneumonia, diminuição de sódio. POSOLOGIA: ENHERTU® deve ser administrado em infusão intravenosa a cada 3 semanas (ciclo de 21 dias), até progressão da doença ou toxicidade não manejável. Câncer de mama, câncer de pulmão, outros tumores sólidos: a dose recomendada é 5,4 mg/kg. Câncer gástrico: a dose recomendada é 6,4 mg/kg. Pode ser necessária a interrupção temporária, redução de dose ou descontinuação do tratamento com ENHERTU® em decorrência de reações adversas. USO RESTRITO A ESTABELECIMENTOS DE SAÚDE. VENDA SOB PRESCRIÇÃO MÉDICA. Registro: 1.0454.0191. Registrado por: Daiichi Sankyo Brasil Farmacêutica Ltda. Serviço de Atendimento ao Consumidor: 0800-055-6596. Informações adicionais à disposição da classe médica. SE PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO. MB_07



 Câncer de Mama
Câncer de Mama Câncer
Gastrointestinal
Câncer
Gastrointestinal Câncer
de Pulmão
Câncer
de Pulmão